ဇူလိုင်လ 5 ရက်နေ့တွင် Novo Nordisk သည် တရုတ်နိုင်ငံတွင် CagriSema ထိုးဆေး၏ အဆင့် III ၏လက်တွေ့စမ်းသပ်မှုကို စတင်ခဲ့ပြီး တရုတ်နိုင်ငံရှိ အဝလွန်သူများနှင့် အဝလွန်လူနာများတွင် CagriSema ဆေးထိုးခြင်း၏ ဘေးကင်းမှုနှင့် ထိရောက်မှုကို နှိုင်းယှဉ်ရန် ရည်ရွယ်ချက်ဖြစ်သည်။
CagriSema ထိုးဆေးသည် Novo Nordisk မှတီထွင်ထုတ်လုပ်ထားသောကြာရှည်စွာတွဲဖက်ကုထုံးဖြစ်ပြီး အဓိကအစိတ်အပိုင်းများမှာ GLP-1 (glucagon-like peptide-1) receptor agonist smeglutide နှင့် တာရှည်ခံသော amylin analog caggrilintide တို့ဖြစ်သည်။CagriSema ထိုးဆေးကို တစ်ပတ်လျှင် တစ်ကြိမ် အရေပြားအောက်၌ ထိုးနိုင်သည်။
အဓိကရည်ရွယ်ချက်မှာ CagriSema (2.4 mg/2.4 mg) ကို အပတ်စဉ် အရေပြားအောက်၌ တစ်ကြိမ် semeglutide သို့မဟုတ် placebo နှင့် နှိုင်းယှဉ်ရန်ဖြစ်သည်။Novo Nordisk သည် CagriSema ၏ hypoglycemic အကျိုးသက်ရောက်မှုသည် semeglutide ထက် သာလွန်ကြောင်း သက်သေပြခဲ့သည့် အဆင့် 2 ဆီးချိုရောဂါအတွက် CagriSema စမ်းသပ်မှု၏ ရလဒ်များကို ထုတ်ပြန်ကြေညာခဲ့ပြီး ဘာသာရပ်များ၏ 90% နီးပါးသည် HbA1c ပန်းတိုင်ကို အောင်မြင်ခဲ့ကြသည်။
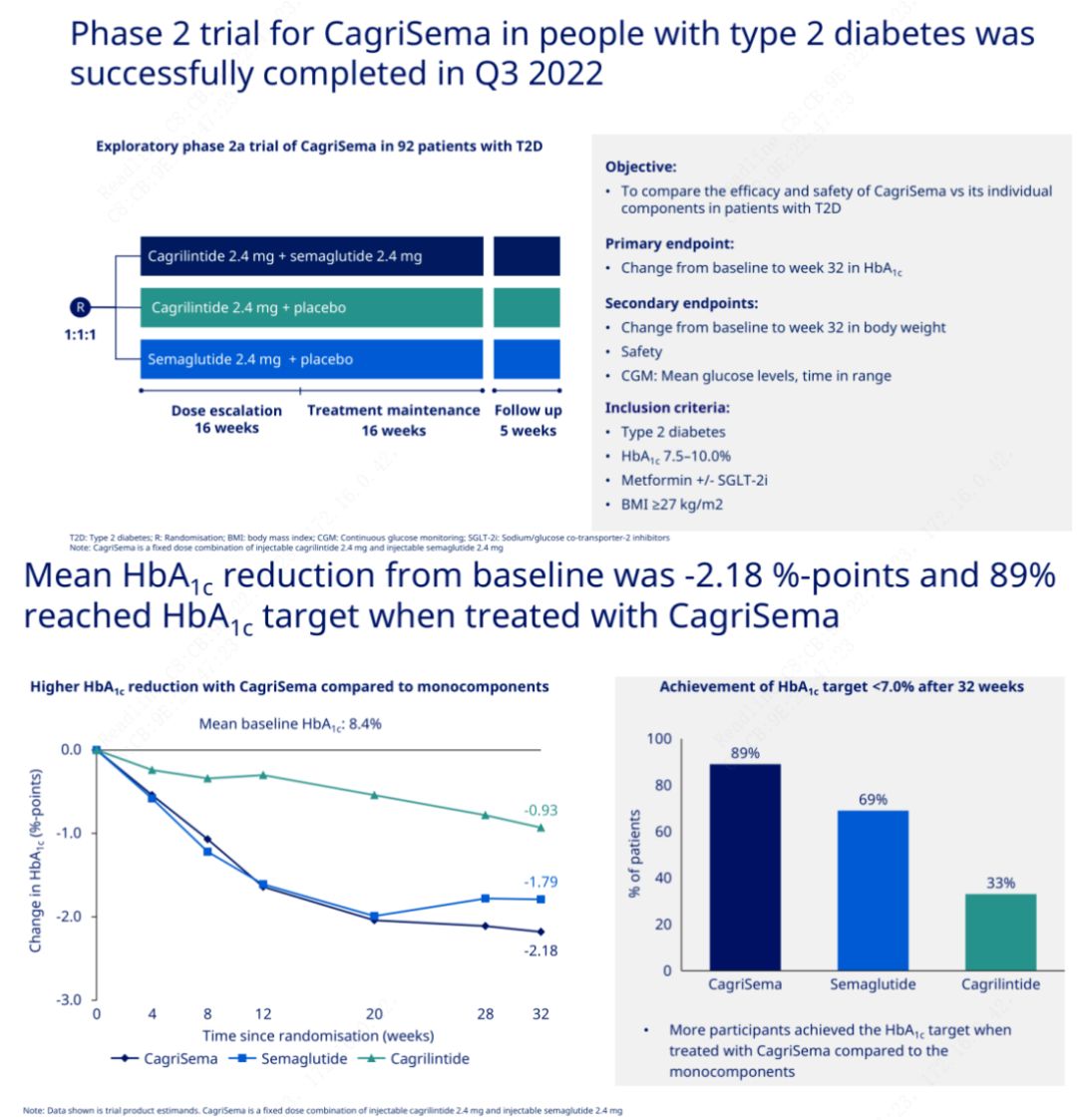
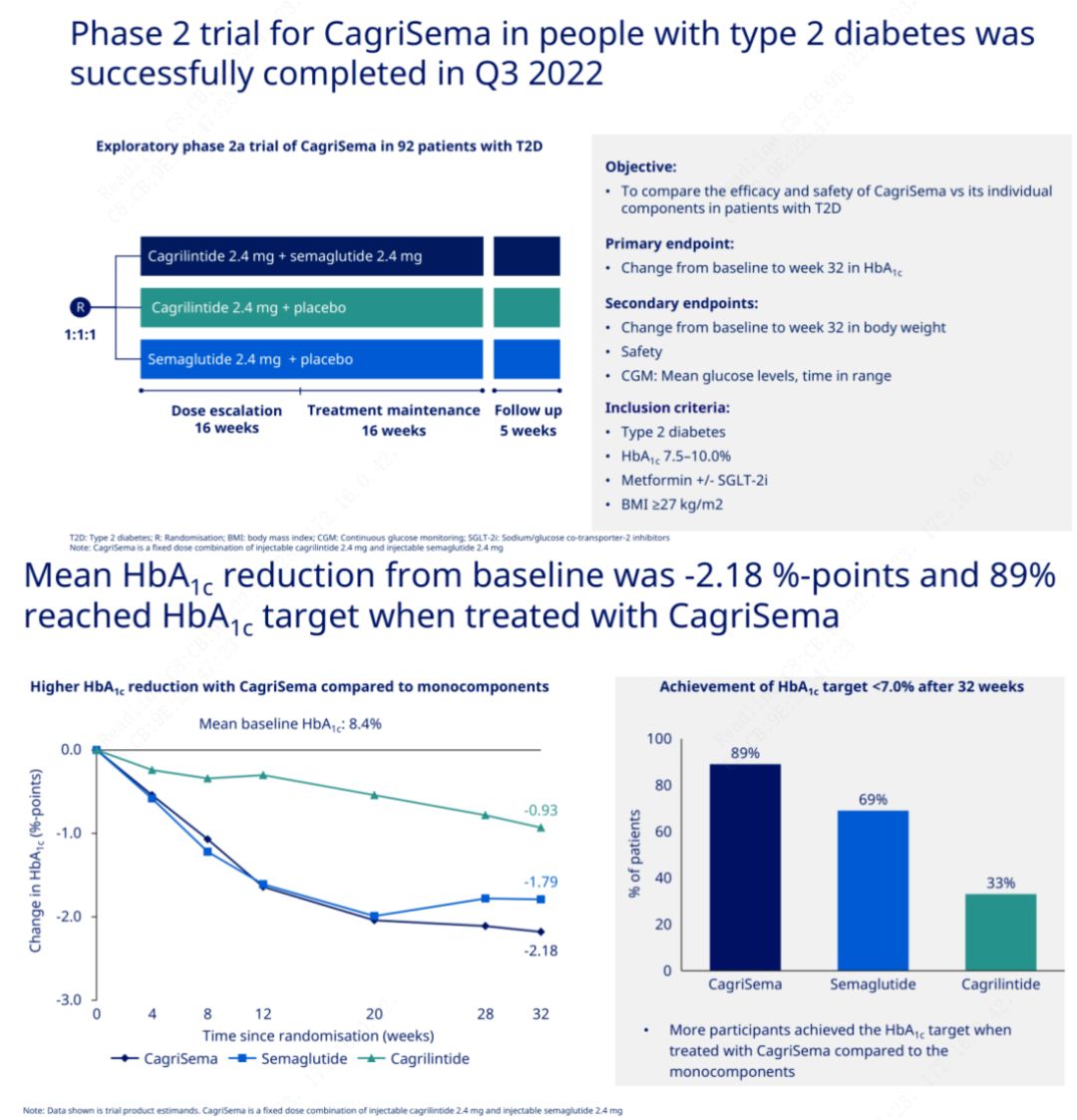
အချက်အလက်များအရ သိသာထင်ရှားသော hypoglycemic အကျိုးသက်ရောက်မှုအပြင် ကိုယ်အလေးချိန်လျှော့ချခြင်းအတွက် CagriSema ထိုးဆေးသည် semeglutide (5.1%) နှင့် cagrilintide (8.1%) ကိုယ်အလေးချိန် 15.6% တို့ကို သိသိသာသာ ကျော်လွန်ခဲ့ကြောင်း ဒေတာများက ပြသခဲ့သည်။
ဆန်းသစ်သောဆေး Tirzepatide သည် ကမ္ဘာ့ပထမဆုံးခွင့်ပြုထားသော အပတ်စဉ် GIP/GLP-1 receptor agonist ဖြစ်သည်။၎င်းသည် incretins နှစ်ခု၏ အာနိသင်များကို တစ်ပတ်လျှင်တစ်ကြိမ် ထိုးသွင်းသည့် မော်လီကျူးတစ်ခုသို့ ပေါင်းစပ်ကာ အမျိုးအစား 2 ဆီးချိုရောဂါအတွက် ကုသမှုအသစ်တစ်ခုဖြစ်သည်။Tirzepatide သည် အမျိုးအစား 2 ဆီးချိုရောဂါရှိသောအရွယ်ရောက်ပြီးသူများတွင် glycemic ထိန်းချုပ်မှု (အစားအသောက်အခြေခံနှင့်လေ့ကျင့်ခန်း) ကိုတိုးတက်စေရန်အတွက် US Food and Drug Administration (FDA) မှ မေလ 2022 ခုနှစ်တွင် အတည်ပြုခဲ့ပြီး အမျိုးအစား 2 ဆီးချိုရောဂါရှိသောအရွယ်ရောက်ပြီးသူများတွင်လက်ရှိတွင်ဥရောပသမဂ္ဂ၊ ဂျပန်နှင့်အခြားနိုင်ငံများ၌အတည်ပြုထားသည်။
ဇူလိုင်လ 5 ရက်နေ့တွင် Eli Lilly သည် အမျိုးအစား 2 ဆီးချိုဝေဒနာရှင်များအား ကုသရန်အတွက် ဆေးဝါးလက်တွေ့စမ်းသပ်မှုမှတ်ပုံတင်ခြင်းနှင့် သတင်းအချက်အလက်ထုတ်ဖော်ခြင်းပလပ်ဖောင်းတွင် အဆင့် III SURPASS-CN-MONO လေ့လာမှုအား ကြေညာခဲ့သည်။SURPASS-CN-MONO သည် အမျိုးအစား 2 ဆီးချိုရောဂါရှိသူများသည် placebo နှင့်နှိုင်းယှဉ်ပါက tirzepatide monotherapy ၏ထိရောက်မှုနှင့်ဘေးကင်းမှုကိုအကဲဖြတ်ရန်ရည်ရွယ်ထားသောကျပန်း၊ နှစ်ဆကန်းသော၊ placebo-ထိန်းချုပ်ထားသောအဆင့် III လေ့လာမှုတစ်ခုဖြစ်သည်။လေ့လာမှု 1 မတိုင်မီ ရက်ပေါင်း 90 အတွင်း မည်သည့်ဆီးချိုရောဂါကိုမဆို မသောက်ဘဲ အမျိုးအစား 2 ဆီးချိုဝေဒနာရှင် 200 ကို ထည့်သွင်းရန်စီစဉ်ထားပါသည် (ပြင်းထန်သောနာမကျန်းမှု၊ ဆေးရုံတက်ခြင်း သို့မဟုတ် ရွေးချယ်ခွဲစိတ်မှုကဲ့သို့သော အချို့သောလက်တွေ့အခြေအနေများမှလွဲ၍ ကျန်အချိန်တို (≤14)၊ ရက်များ) အင်ဆူလင်အသုံးပြုမှု။
အမျိုးအစား ၂ ဆီးချိုရောဂါကို ယခုနှစ်တွင် အတည်ပြုနိုင်မည်ဟု မျှော်လင့်ရသည်။
ပြီးခဲ့သည့်လက SURPASS-AP-Combo လေ့လာမှု၏ရလဒ်များကို မေလ ၂၅ ရက်နေ့ထုတ် Nature Medicine ဂျာနယ်တွင် ထုတ်ဝေခဲ့သည်။ရလဒ်များအရ အင်ဆူလင် glargine နှင့် နှိုင်းယှဉ်ပါက Tirzepatide သည် အာရှ-ပစိဖိတ်ဒေသရှိ အမျိုးအစား 2 ဆီးချိုရောဂါဝေဒနာရှင်များ (အဓိကအားဖြင့် တရုတ်နိုင်ငံ) တွင် HbA1c လျော့နည်းခြင်းနှင့် ကိုယ်အလေးချိန် 2.49% အထိ လျော့ကျလာပြီး ကိုယ်အလေးချိန် 7.2 ကီလိုဂရမ်အထိ လျော့ကျသွားကြောင်း ပြသခဲ့သည်။ ကုသမှု ရက်သတ္တပတ် ၄၀ တွင် (၉.၄%)၊ သွေးတွင်း lipid နှင့် သွေးပေါင်ချိန် သိသာစွာ တိုးတက်မှု၊ အလုံးစုံ ဘေးကင်းမှုနှင့် ခံနိုင်ရည်အား ကောင်းမွန်သည်။
SURPASS-AP-Combo ၏ Phase 3 ၏လက်တွေ့စမ်းသပ်မှုသည် Tirzepatide ၏ပထမဆုံးလေ့လာမှုဖြစ်ပြီး Peking University People's Hospital မှပါမောက္ခ Ji Linong ဦးဆောင်သောအမျိုးအစား 2 ဆီးချိုရောဂါရှိသောတရုတ်လူနာများတွင်အဓိကအားဖြင့်ပြုလုပ်သောပထမဆုံးလေ့လာမှုဖြစ်သည်။SURPASS-AP-Combo သည် ကမ္ဘာလုံးဆိုင်ရာ SURPASS သုတေသနစီးရီး၏ ရလဒ်များနှင့် ကိုက်ညီပြီး တရုတ်လူနာများတွင် ဆီးချိုရောဂါ၏ ဇီဝကမ္မဗေဒသည် ကမ္ဘာလုံးဆိုင်ရာ လူနာများနှင့် ကိုက်ညီကြောင်း၊ ဆေးဝါးအသစ်များ၏ တပြိုင်နက် သုတေသနနှင့် ဖွံ့ဖြိုးတိုးတက်မှုအတွက် အခြေခံဖြစ်သည့်၊ တရုတ်နိုင်ငံနှင့် ကမ္ဘာတစ်ဝှမ်းရှိ တရုတ်လူနာများအား နောက်ဆုံးပေါ် ဆီးချိုရောဂါကုသဆေးများနှင့် ၎င်းတို့၏ လက်တွေ့အသုံးချမှုကို တရုတ်နိုင်ငံတွင် အမြန်ဆုံးအသုံးပြုနိုင်စေရန် ခိုင်မာသောအထောက်အထားများ ပံ့ပိုးပေးပါသည်။
တင်ချိန်- စက်တင်ဘာ-၁၈-၂၀၂၃

